W latach 2015–2019 Europejska Agencja Leków zarejestrowała 173 nowe produkty lecznicze, natomiast w tym samym okresie czasu amerykańska Agencja Żywności i Leków dopuściła do obrotu 220 produktów leczniczych. Wynika z tego, że FDA zarejestrowała o 47 (21 proc.) nowych leków więcej niż EMA. W tym okresie FDA zarejestrowała 59 nowych leków przeciwnowotworowych, a EMA – 50.
Nowe substancje czynne stosowane w terapii nowotworów w 2015 r. stanowiły 33 proc. wszystkich nowych substancji czynnych wprowadzonych do obrotu przez Europejską Agencję Leków. W 2016 r. ich udział wynosił 37 proc., w 2017 r. substancje czynne w terapii nowotworów stanowiły 26 proc., w 2018 r. – 26 proc., a w 2019 r. 23 proc. wszystkich zarejestrowanych nowych substancji czynnych. Najwięcej nowych substancji czynnych zarejestrowane we wskazaniu do leczenia nowotworów płuc – 21 proc. wszystkich.
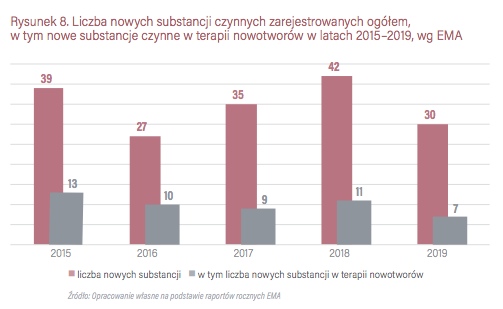
Nowe leki rejestrowane przez EMA w latach 2015-2019 miały następujące wskazania:
- rak płuca – 12 nowych cząsteczek
- czerniak – 6 nowości
- rak piersi, białaczka, szpiczak plazmocytowy, chłoniak – po 5 nowości
- rak nerki – 4 nowości
- rak prostaty, nowotwór skóry – po 3 nowości
- nowotwory neuroendokrynne i rak jajników – po 2 nowości
- inne guzy lite, mięsak, neuroblastoma, nowotwór jelita grubego, nowotwór tarczycy, policytemia – po jednej nowości
Natomiast amerykańska Agencja Żywności i Leków w latach 2015–2019 najwięcej nowych czasteczek wprowadziła do obrotu w obszarze leczenia nowotworów piersi i płuc – po 7 oraz ostrej białaczki szpikowej i szpiczaka plazmocytowego – po 5 leków.
FDA w 2019 r. zarejestrowała 48 nowych produktów leczniczych, w tym 12 w terapii nowotworów. W 2018 r. – 59 nowych produktów ogółem, w tym 16 w terapii nowotworów. W 2017 r. zarejestrowała 12 nowych leków w terapii nowotworów spośród 46 wszystkich nowych substancji czynnych, w 2016 r. – 6 spośród 22 nowych substancji, w 2015 r. – 13 spośród 45 zatwierdzonych nowych substancji.
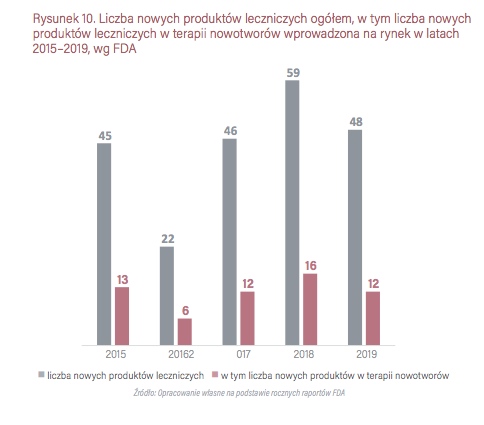
Porównując dane za poszczególne lata można zauważyć, że w ostatnich trzech latach – 2016, 2017 i 2019 EMA rejestrowała mniej nowych leków ogółem w porównaniu do FDA, choć nie były to znaczące różnice. Przy czym w 2015 roku zarejestrowały tyle samo produktów leczniczych w onkologii, w 2016 roku EMA zarejestrowała o 4 produkty lecznicze w onkologii więcej, z kolei w 2017 roku FDA zarejestrowała o 3 produkty lecznicze w onkologii więcej niż EMA. W 2018 i 2019 roku FDA zarejestrowała więcej produktów leczniczych w obszarze leczenia nowotworów – odpowiednio o 5 więcej w 2018 roku oraz o 5 więcej w 2019 roku.
Jak mówi dr Jakub Gierczyński, autor rozdziału analizującego rejestracje EMA i FDA w raporcie “Rozwój terapii lekowych w leczeniu chorych na nowotwory”, w ostatnich latach liczba nowych leków onkologicznych – wbrew potocznym opiniom – nie wzrastała, ale utrzymuje się na stabilnym poziomie. Nie maleje jednak liczba zarejestrowanych nowych cząsteczek, oczekujących na objęcie refundacją w Polsce.
Raport “„Rozwój terapii lekowych w leczeniu chorych na nowotwory – Nowości. Innowacje. Przełomy”
Analiza rejestracji nowych leków onkologicznych – to fragment raportu “„Rozwój terapii lekowych w leczeniu chorych na nowotwory – Nowości. Innowacje. Przełomy”. Autorzy raportu zaprezentowali wnioski i rekomendacje dotyczące wyboru i finansowania terapii onkologicznych. Są to: prof. Marcin Czech, dr Magdalena Władysiuk, dr Jakub Gierczyński, Krzysztof Jakubiak i Dominika Krupa. Z analiz wynika, że konieczne jest skrócenie czasu od pierwszej rejestracji nowych cząsteczek do refundacji. Przy wyborze priorytetowych terapii trzeba uwzględnić także nierównomierny rozwój technologii dotyczących poszczególnych typów nowotworów, tak aby wyrównać szanse różnych grup pacjentów. Niezbędne jest także stosowanie algorytmów oceny, uzupełnionych jednocześnie o analizę najnowszych danych klinicznych dotyczących skuteczności terapii – to najważniejsze wnioski z raportu.
Więcej o raporcie – na mZdrowie.pl.
© mZdrowie.pl








































































