W latach 2012–2020 amerykańska Agencja Żywności i Leków uznało za przełomowe 42 nowe terapie onkologiczne. Wszystkie przełomowe terapie (w sumie 11) z lat 2013–2015 są aktualnie refundowane w Polsce. Spośród 13 uznanych za przełomowe w latach 2016–2017, w Polsce refundację mają trzy. Warto też podkreślić, że refundacja wspomnianych leków nie zawsze dotyczy wszystkich wskazań. Natomiast wszystkie zarejestrowane od początku 2018 roku – w sumie 18 – nie są jeszcze refundowane.
Amerykańska Agencja Żywności i Leków autoryzuje do obrotu nowe leki zwykle wcześniej niż Europejska Agencja Leków. Dokonuje jednocześnie wstępnej kategoryzacji nowych cząsteczek, przyznając niektórym miano terapii przełomowej (breakthrough) lub pierwszej w swojej klasie (first-in–class). Zaliczenie nowej cząsteczki do tych grup może służyć jako wskazanie do określenia priorytetów dla decyzji refundacyjnych w przyszłości, chociaż nie rozwiązuje bieżących dylematów.
Liczba nowych terapii onkologicznych uznawanych przez FDA za przełomowe rośnie od 2017 roku znacznie szybciej niż uprzednio. W 2020 roku, do 11 czerwca, FDA dokonało już rejestracji 10 nowych leków onkologicznych, spośród 23 wszystkich nowości. Sześciu z nich przyznano wskazanie terapii przełomowej, były to: avapritinib (Ayvakit, GIST), pemigatynib (Pemazyre, rak przewodu żółciowego), sacituzumab govitecan-hziy (Trodelvy, rak piersi), campatinib (Tabrecta, niedrobnokomórkowy rak płuca), selpercatinib (Retevmo, rak płuca i rak tarczycy), ripretinib (Qinlock, rak przewodu żółciowego).
W 2019 roku FDA zarejestrowała 48 nowych leków, 20 spośród nich uznając jako first-in-class. Do nich zaliczono 5 leków onkologicznych: erdafitinib (Balversa), enfortumab vedotin (Padcev), polatuzumab vedotin (Polivy), pexidartinib (Turalio), selinexor (Xpovio). Natomiast 13 leków uznano za przełomowe. Wśród nich znalazło się 7 onkologicznych: Balversa, Padcev, Polivy, Turalio oraz zanubrutinib (Brukinsa), fam-trastuzumab deruxtecan-nxki (Enhertu) i entrectinib (Rozlytrek).
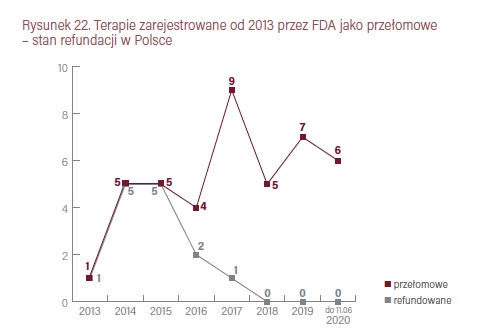
W 2018 roku FDA zarejestrowała 59 nowych leków, uznając 19 jako first-in-class. Zaliczono do nich 5 onkologicznych tagraxofusp (Elzonris), mogamulizumab (Poteligeo), larotrectinib (Vitrakvi), lutetium dotatate (Lutathera), ivosidenib (Tibsovo). Natomiast 14 leków uznano za terapie przełomowe. Wśród nich znalazło się 5 onkologicznych: Elzonris, Poteligeo, Vitrakvi oraz cemiplimab (Libtayo) i lorlatinib (Lorbrena).
W 2017 roku FDA zarejestrowała 46 nowych leków, definiując 15 z nich jako first-in-class, do których zaliczono 3 onkologiczne: inotuzumab ozogamicin (Besponsa), midostaurin (Rydapt), enasidenib (Idhifa, wycofany przez EMA w 2019 roku). Jednocześnie 17 leków uznano za terapie przełomowe. Wśród nich znalazło się 9 leków onkologicznych: Besponsa, Rydapt oraz brigatinib (Alunbrig), avelumab (Bavencio), acalabrutinib (Calquence), durvalumab (Imfinzi), ribociclib (Kisqali), abemaciclib (Verzenios), niraparib (Zejula). Spośród nich jeden (ribociclib) jest dziś refundowany w Polsce.
W 2016 roku FDA zarejestrowała 22 nowe leki, definiując 8 z nich jako first-in-class, w tym jeden onkologiczny: venetoclax (Venclexta, rejestracja EMA pod nazwą Venclyxto). Jednocześnie 7 leków uznano za terapie przełomowe. Wśród nich znalazły się 4 leki onkologiczne: venetoclax, atezolizumab (Tecentriq), rucaparib (Rubraca) oraz olaratumab (Lartruvo, aktualnie wycofany). Dwa spośród nich (atezolizumab i venetoclax) są już refundowane w Polsce.
W 2015 roku FDA zarejestrowała 45 nowych leków, definiując 16 z nich jako first-in-class, do których zaliczono 3 onkologiczne: daratumumab (Darzalex), elotuzumab (Empliciti), palbociclib (Ibrance). Jednocześnie 10 leków uznano za terapie przełomowe. Wśród nich znalazło się 5 leków onkologicznych: Darzalex, Empliciti, Ibrance oraz alectinib (Alecensa) i osimertinib (Tagrisso) Wszystkie poza jednym (elotuzumab, zarejestrowany przez EMA w 2016 roku) są już w Polsce objęte refundacją.
W 2014 roku FDA zarejestrowała 41 nowych leków, w tym 9 do leczenia nowotworów. Cztery leki onkologiczne (na 17 ogółem) zdefiniowano jako first-in-class: olaparib (Lynparza), blinatumomab (Blincyto), pembrolizumab (Keytruda), idelalisib (Zydelig). Natomiast 9 nowych leków uznano za terapie przełomowe, w tym pięć leków onkologicznych: Blincyto, Keytruda, Zydelig oraz nivolumab (Opdivo) i ceritinib (Zykadia). Spośród wszystkich wymienionych tylko jeden (idelalisib) nie został objęty refundacją w Polsce.
W 2013 roku FDA zarejestrowała 9 nowych leków onkologicznych (na 27 ogółem). Cztery leki do leczenia nowotworów zdefiniowano jako first-in-class: ibrutinib (Imbruvica), radium Ra-223 dichloride (Xofigo), trametinib (Mekinist) i ado-trastuzumab emtansine (Kadcyla). Trzy nowe terapie uznano za przełomowe, w tym także jeden lek onkologiczny – Imbruvica. Wszystkie cztery wymienione terapie są już objęte refundacją w Polsce.
Jak mówi dr Magdalena Władysiuk, autorka rozdziału refundację nowych terapii onkologicznych w raporcie “Rozwój terapii lekowych w leczeniu chorych na nowotwory” – “Znaczne przyspieszenie wydawania decyzji refundacyjnych w ostatnich 3 latach zahamowało narastające opóźnienia związane z zaleceniami wytycznych klinicznych w Polsce i na świecie. Jednak żeby Polska nadrobiła dystans i mogła nadążyć za tempem rozwoju technologii lekowych w onkologii, liczba nowych cząsteczek wprowadzanych na listę refundacyjną powinna co najmniej utrzymywać się na podobnym liczbowo poziomie, a najlepiej wzrosnąć o przynajmniej 25 proc. w skali roku”.
Raport “„Rozwój terapii lekowych w leczeniu chorych na nowotwory – Nowości. Innowacje. Przełomy”
Analiza terapii uznanych przez FDA za przełomowe – to fragment raportu “„Rozwój terapii lekowych w leczeniu chorych na nowotwory – Nowości. Innowacje. Przełomy”. Raport zawiera wnioski i rekomendacje dotyczące wyboru i finansowania terapii onkologicznych. Autorami są: prof. Marcin Czech, dr Magdalena Władysiuk, dr Jakub Gierczyński, Krzysztof Jakubiak i Dominika Krupa. Z analiz wynika, że konieczne jest skrócenie czasu od pierwszej rejestracji nowych cząsteczek do refundacji. Przy wyborze priorytetowych terapii trzeba uwzględnić także nierównomierny rozwój technologii dotyczących poszczególnych typów nowotworów, tak aby wyrównać szanse różnych grup pacjentów. Niezbędne jest także stosowanie algorytmów oceny, uzupełnionych jednocześnie o analizę najnowszych danych klinicznych dotyczących skuteczności terapii – to najważniejsze wnioski z raportu.
Więcej o raporcie – na mZdrowie.pl.
© mZdrowie.pl








































































