Utworzenie Funduszu Medycznego ma przyspieszyć dostęp do nowych leków w zakresie indywidualnego dostępu ratunkowego (RDTL) oraz systemowego do innowacji. Minęło 7 miesięcy i uruchomiono jedynie budżet na RDTL – wskazuje raport HTA Consulting.
Robert Plisko, prezes HTA Consulting:
W ustawie o Funduszu Medycznym, oprócz wprowadzenie nowych rozwiązań związanych z ratunkowym dostępem jako indywidualnego dostępu do najnowszych terapii (RDTL), przedstawiono nowy system oceny innowacyjności nowych leków. Został on podzielony na dwie ścieżki:
1 – technologii lekowych stosowanych w chorobach rzadkich i onkologii (zarejestrowanych od 2020 roku) – leki o wysokim poziomie innowacyjności – TLWI
2 – wszystkich technologii medycznych (zarejestrowanych od 2017 roku) – technologii o wysokiej wartości klinicznej – TLWK.
Zapisy ustawy o Funduszu Medycznym mają gwarantować stabilny mechanizm finansowania dla nowych technologii lekowych, dzięki przeznaczeniu dodatkowych, nowych środków finansowych na refundację, które są kluczowe do realizacji założonych celów ustawy.
Fundusz Medyczny a całkowity budżet na refundację (CBR)
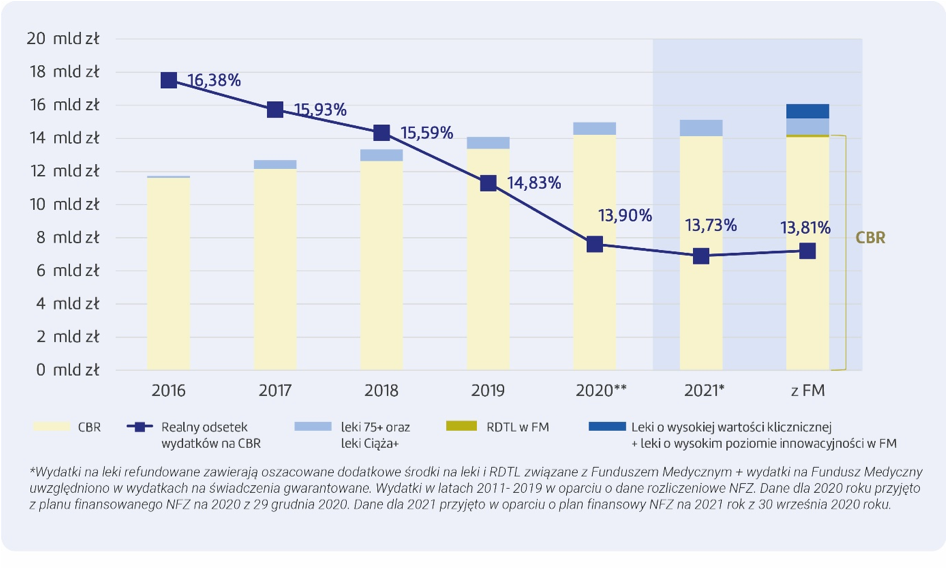
Ustawa o Funduszu Medycznym określiła maksymalne wydatki płatnika publicznego na RDTL oraz – osobno – dodatkowe środki na leki innowacyjne. Wysokość nakładów Funduszu została powiązana z wysokością Całkowitego Budżetu Refundacyjnego. Oznacza to, że im mniejszy będzie przyrost wydatków na CBR, tym niższy budżet Funduszu Medycznego na te leki.
Bezwzględne wydatki na refundację z roku na rok rosną, lecz mimo to Całkowity Budżet Refundacyjny jest coraz bardziej odległy od maksymalnego progu 17 proc. rocznych wydatków NFZ na świadczenia gwarantowane, który założono w ustawie w 2012 roku Spośród wydatków na leki z Funduszu Medycznego, do końca czerwca uruchomione zostało jedynie finansowanie leków w ramach RDTL, których maksymalny roczny limit w tym roku może wynieść ok. 160 mln zł (prognoza na podstawie planów NFZ). Łączne wydatki NFZ na CBR razem z lekami dla seniorów (75+), kobiet w ciąży (Ciąża+) oraz Funduszem Medycznym – to poziom 15,2% wydatków na świadczenia gwarantowane w 2021 roku.
Wydatki na CBR w latach 2016-2020 oraz leki 75+/ciąża+ a zmiana wysokości wydatków CBR po wprowadzeniu Funduszu Medycznego w 2021 roku:
Ratunkowy dostęp do technologii lekowych (RDTL)
Niezależnie od ograniczeń budżetowych, konieczna jest analiza rzeczywistego dostępu do nowych terapii, szczególnie w mechanizmie RDTL. Został on uproszczony proceduralnie – przeniesiono podejmowanie decyzji klinicznych na poziom lekarza prowadzącego i konsultantów klinicznych, a decyzji finansowych – na poziom dyrektora szpitala. Miało to w teorii ułatwić dostęp pacjentów do nowych technologii medycznych. Niestety okazało się, że mechanizmy związane z finansowaniem RDTL na poziomie poszczególnych szpitali (w ramach kontraktu z NFZ) stanowią barierę, która ogranicza dostęp pacjentów do leków. Może to oznaczać, że wydatki na RDTL w 2021 roku nie zostaną wykorzystane do maksymalnego pułapu. Dodatkowo ograniczenia są związane z negatywnymi rekomendacjami AOTMIT – pomimo, że nie podważają one skuteczności czy bezpieczeństwa danej terapii, a są podyktowane argumentami ekonomicznymi. W dodatku brakuje publicznych danych dotyczących liczby leczonych, stosowanych terapii czy centralnego rejestru wniosków.
W zakresie leków innowacyjnych założono maksymalny budżet 707 mln zł (prognoza na podstawie planów NFZ). W lutym 2021 roku AOTMiT po raz pierwszy opublikowała wykaz leków o wysokim poziomie innowacyjności. W sierpniu agencja opublikuje wykaz leków o wysokiej wartości klinicznej. Celem obu list jest przyspieszenie lub zmniejszenie opóźnienia w dostępie do terapii o udowodnionej efektywności klinicznej. Nadal niejasne są stopnie innowacyjności ocenionych leków (np. niska, średnia, wysoka – jak we Włoszech) oraz kryteria selekcji technologii lekowych przyjęte przez AOTMiT i Ministerstwo Zdrowia.
Leki o wysokim poziomie innowacyjności
Pierwsza przedstawiona przez MZ propozycja listy technologii o wysokim poziomie innowacyjności nie obejmuje w ogóle leków onkologicznych. Zawiera jedynie 5 leków stosowanych w chorobach rzadkich, którymi może być leczonych do 300 pacjentów rocznie. Pierwsze zapowiadane decyzje refundacyjne dotyczące tych terapii będą wydane w czwartym kwartale 2021, co oznacza, że z planowanego maksymalnego budżetu 707 mln na 2021 rok zostanie wydana jedynie część.
Brak ciągłego procesu oceny innowacyjnych leków spowoduje, że kolejna propozycja wykazu dla tej kategorii leków zostanie przez AOTMiT ogłoszona w lutym 2022 – w powtarzającym się corocznym cyklu. W wielu przypadkach może się okazać, że złożenie wniosku refundacyjnego w ramach standardowej procedury może doprowadzić do uzyskania refundacji wcześniej niż w ramach Funduszu Medycznego. Co istotne – producenci technologii z tej listy w przypadku uzyskania refundacji będą zobowiązani do złożenia pełnego wniosku refundacyjnego wraz z raportem HTA w związku z przedłużeniem pierwszej decyzji refundacyjnej i obowiązującymi obecnie kryteriami w regularnej refundacji. Taki kształt finansowania innowacyjnych technologii lekowych, nazywany przez płatnika warunkową refundacją, nakłada wiele dodatkowych obowiązków na producentów leków, bez uproszczenia procedur oceny czy też zakresu składanego wniosku. Jednocześnie wprowadza nowe mechanizmy ustalania cen w oparciu o wyniki rejestru i ceny efektywne, uzyskane na ich podstawie w ramach instrumentów podziału ryzyka.
Warto rozważyć, czy nowe technologie innowacyjne nie powinny być na bieżąco oceniane przez AOTMiT, gdyż dałoby to realną możliwość zrealizowania postulatu o przyśpieszeniu w dostępie do nowych terapii. Kolejna zmiana do rozważenia – to uproszczenie zakresu danych wymaganego od raportu HTA składanego przy przedłożeniu decyzji refundacyjnej. W świetle zmian zapowiadanych w Narodowym Planie dla Chorób Rzadkich oraz nowelizacji ustawy refundacyjnej, istotne jest także dookreślenie roli regularnej i warunkowej refundacji w chorobach rzadkich i onkologicznych.
Leki o wysokiej wartości klinicznej
Lista leków o wysokiej wartości klinicznej zostanie ogłoszona jedynie raz i dotyczyć będzie leków zarejestrowanych od 2017 roku. Zapisy ustawy dopuszczają do złożenia wniosku dla każdej technologii lekowej (leki na receptę oraz leki szpitalne), jednak ustawa nakazuje przedstawienie propozycji programu lekowego. Ten obowiązek utrudni dostęp pacjentów do tej formy finansowania leków. Jednocześnie wskazuje na to, że nie przewidziano finansowania w tym trybie leków stosowanych w szerokich populacjach.
Ze względu na opublikowanie przez AOTMiT wykazu w sierpniu 2021 oraz na czas trwania procesu refundacyjno-cenowego (240 dni), pierwsze decyzje zapadną prawdopodobnie w drugiej połowie 2022 roku. Przy odnowieniu decyzji refundacyjnej w tej kategorii konieczne będzie ponowne składanie wniosku refundacyjnego wraz z raportem HTA. Wydaje się to nadmiernym obciążeniem administracyjnym, którego cel jest niejasny – w świetle obowiązku składania pełnego raportu HTA w procesie podejmowania pierwszej decyzji oraz objęcia rejestrem w przypadku refundacji.
Podsumowanie
Rząd zapowiada nowelizację ustawy refundacyjnej. Wydaje się konieczne, aby przy tej okazji zrealizować postulaty kompleksowych zmian w systemie refundacyjnym, ale również wprowadzić poprawki już zgłaszane do ustawy o Funduszu Medycznym.
Każdą nową regulację dotyczącą refundacji leków należy oceniać pod kątem rzeczywistego dostępu pacjentów do leków – czyli czasu trwania procesów refundacyjnych, równego i rzeczywistego dostępu do terapii (co jest istotne w przypadku RDTL), dostępu do informacji o możliwościach leczenia czy liczby refundowanych nowych leków w stosunku do rejestrowanych przez Europejską Agencję Leków. Wszyscy mamy świadomość, że nie jest możliwa refundacja w Polsce wszystkich zarejestrowanych leków. Pytanie – czy możliwa jest realna zmiana sytuacji i realny postęp w tym obszarze.
Raport HTA Consulting do pobrania:








































































